Conjugados de Puromicina para marcação específica C-terminal in vitro e monitoramento da síntese proteica in vivo
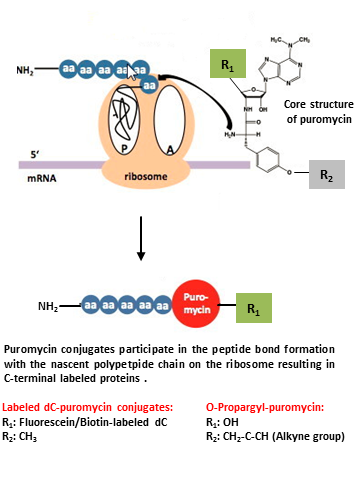
O antibiótico puromicina é um análogo estrutural do aminoacil-RNAt que tem sido tradicionalmente utilizado como inibidor da síntese proteica, uma vez que se incorpora especificamente no terminal C das cadeias polipeptídicas nascentes, interrompendo assim a tradução. Com base nesta observação, uma abordagem nova e significativamente mais rápida, utilizando conjugados de puromicina marcados, pode ser aplicada tanto à marcação C-terminal específica de proteínas completas in vitro [1,2,3,4] como à monitorização não radioactiva da síntese proteica global in vivo [5,6,7].
Conjugados de dC-puromicina marcados: Marcação específica da proteína C-terminal de uma proteína full-length in vitro.
As proteínas completas marcadas no C-terminal podem ser produzidas por tradução in vitro na presença de baixas concentrações de conjugados marcados com dC-puromicina[1].
Estas proteínas têm sido utilizadas com sucesso para analisar interações proteína-proteína (ensaio de pull-down, FCCS, microarrays de proteína-proteína) e interacções proteína-DNA (DNA microarrays)[2, 3, 4].
Em contraste com as abordagens de marcação pós-traducional tradicionalmente aplicadas, etapas adicionais de purificação que consomem muito tempo são aqui evitadas a expressão e a marcação das proteínas é feita simultaneamente.
O-Propargil-puromicina: Monitoramento da síntese global de proteínas in vivo
Os estudos atuais do nível de proteína celular dependem de métodos indiretos, como microarrays de DNA e mRNA ou marcação metabólica radioativa clássica com 35S-metionina.
A O-Propargil-puromicina é permeável às células e prontamente incorporada às proteínas recém-traduzidas, proporcionando um método sensível e não radioativo para o monitoramento direto da síntese global de proteínas[5].
As proteínas resultantes marcadas no C-terminal com alquino podem ser detectadas por meio da química de clique catalisada por Cu(I), que oferece a opção de introduzir um grupo de biotina (Azidas contendo reagentes de Biotina) para ensaios subsequentes de purificação ou um grupo fluorescente (Azidas contendo marcadores fluorescentes) para ensaios subsequentes de microscopia.
Produtos
Selected References
[1] Miyamoto-Sato et al. (2000) Specific bonding of puromycin to full-length protein at the C-terminus. Nucleic Acids Res. 28 (5):1176.
[2] Nemoto et al. (1999) Fluorescence labeling of the C-terminus of proteins with a puromycin analogue in cell-free translation systems. FEBS Letters 462:43.
[3] Doi et al. (2002) Novel Fluorescence Labeling and High-Throughput Assay Technologies for In Vitro Analysis of Protein Interactions. Genome Research 12:487.
[4] Kawahashi et al. (2007) High-throughput fluorescence labeling of full-length cDNA products based on a reconstituted translation system. J. Biochem. 141 (1):19.
[5] Liu et al. (2012) Imaging protein synthesis in cells and tissues with an alkyne analog of puromycin. Proc Natl Acad Sci USA. 109 (2):413.
[6] Stark et al. (2004) A General Approach to Detect Protein Expression In Vivo Using Fluorescent Puromycin Conjugates. Chemistry & Biology 11:999.
[7] Godman et al. (2011) Novel insights into the regulation of skeletal muscle protein synthesis as revealed by a new nonradioactive in vivo technique. The FASEB Journal 25:1028.
